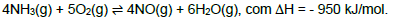cód. #10983
COPS-UEL - Química - 2018 - Vestibular - 1º Fase
A crescente contaminação ambiental pelas indústrias tem sido combatida com o desenvolvimento de novas técnicas de tratamento de efluentes tóxicos. O processo Fenton, conforme reação 1 a seguir, é um dos procedimentos utilizados no tratamento de efluentes orgânicos.
Reação 1: Fe2+(aq) + H2O2(aq) → Fe3+(aq) + OH−(aq) + OH• (aq) k = 76 (mol L−1) −1 s−1
Na reação 1, há a formação de OH• (radical hidroxila) com potencial oxidante superior ao H2O2. Assim, a eficiência deste processo se dá pela produção de OH•, capaz de oxidar uma ampla variedade de compostos orgânicos gerando CO2, H2O e íons inorgânicos provenientes de heteroátomos. Além da reação 1, é possível ocorrer a reação 2, em que há a formação de HO2•, que, por sua vez, é um oxidante menos reativo que o OH•, diminuindo assim a eficiência do processo Fenton.
Reação 2: H2O2(aq) + OH• (aq) → HO2•(aq) + H2O(l) k = 2,7 x 107 (mol L−1) −1 s−1
Considerando as reações químicas envolvidas e os fatores que podem influenciar na eficiência do processo e com base nos conhecimentos sobre equilíbrio químico cinética química e eletroquímica, assinale a alternativa correta.
A) Na Reação 1, Fe2+ é o agente oxidante e H2O2 é o agente redutor.
B) A eficiência do processo Fenton é maior em meio básico (alcalino).
C) O excesso de H2O2 em relação a Fe2+ diminui a eficiência do processo Fenton.
D)
Sendo a Reação 1 de segunda ordem, e a concentração de Fe2+ e de H2O2 iguais a 2,0 mol L−1, a velocidade será de 504 mol L−1 s−1.
E) A molecularidade de cada uma das equações químicas, reações 1 e 2, é 4.
A
B
C
D
E